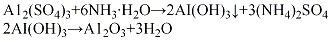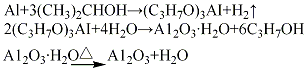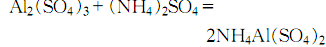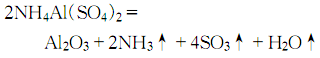化學(xué)性質(zhì)
中文名 氧化鋁
外文名 aluminium oxide
化學(xué)式 Al?O?
分子量 101.96
CAS登錄號 1344-28-1

EINECS登錄號 215-691-6
熔點(diǎn) 2054oC
沸點(diǎn) 2980oC
水溶性 不溶于水�����,易溶于強(qiáng)堿和強(qiáng)酸
密度 3.5 g/cm3
外觀 白色無定形粉狀物
安全性描述 S26���;S24/25��;S16�����;S7��;S36
危險性符號 R36/37/38��;R67����;R36/38;R11���;R36
危險性描述 Xi�����;F
管制 該品不受限制
晶格常數(shù) a=0.514nm
晶體結(jié)構(gòu) O2-離子按六方最密堆積排列
晶體類型 離子型
主要成分
氧化鋁含有元素鋁和氧����。若將鋁礬土原料經(jīng)過化學(xué)處理��,除去硅��、鐵�����、鈦等的氧化物而制得的產(chǎn)物是純度很高的氧化鋁原料,Al2O3含量一般在99%以上��。礦相是由40%~76%的γ- Al2O3和24%~60%的α- Al2O3組成���。γ- Al2O3于950~1200℃可轉(zhuǎn)變?yōu)棣? Al2O3��,同時發(fā)生顯著的體積收縮��。
化學(xué)性質(zhì)
和酸反應(yīng):
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Al2O3 + 6H+ = 2Al3+ + 3H2O
和熔融的堿反應(yīng):
Al2O3 + 2NaOH= 2NaAlO2(偏鋁酸鈉)+ H2O
和堿溶液反應(yīng):
Al2O3+ 2NaOH +3H2O = 2Na[Al(OH)4](四羥基合鋁酸鈉)
也可以簡寫為:Al2O3+2OH-=2AlO2-(偏鋁酸根離子)+H2O
物理性質(zhì)
InChI=1/Al.2O/rAlO?/c2-1-3
分子量:101.96
熔點(diǎn):2054 ℃
沸點(diǎn):2980℃
真密度:3.97 g/cm3
松裝密度:0.85 g/mL(325目~0)0.9 g/mL(120目~325目)
晶體結(jié)構(gòu):三方晶系 (hex)
溶解性:常溫下不溶于水
導(dǎo)電性:常溫狀態(tài)下不導(dǎo)電
Al?O?是離子晶體
熱化學(xué)屬性:
ΔfHθ(l)=1620.57 kJ/mol
ΔfHθ(s)=1675.69 kJ/mol
Sθ(l)= 67.24 J/mol·K(1 bar)
Sθ(s)=50.9 J/mol·K
變體
Al2O3有多種變體�����,常見的是α�����,γ型都是白色晶體。
自然界中的剛玉是α型屬于六方最密堆積����,熔點(diǎn),硬度高�����,不溶于酸堿耐腐蝕,絕緣性好����。
將氫氧化鋁與偏氫氧化鋁或鋁銨礬在723K共熱可得γ型,不溶于水����,但吸水性很強(qiáng),有強(qiáng)吸附能力與催化活性����。
β形有離子傳導(dǎo)能力,允許Na+通過�。
質(zhì)檢指標(biāo)
水中溶解物,% ≤0.5
硅酸鹽合格
堿金屬及堿土金屬����,% ≤0.50
重金屬(以Pb計),% ≤0.005
氯化物���,% ≤0.01
硫酸鹽��,% ≤0.05
灼燒失量��,% ≤5.0
鐵���,% ≤0.01
安全信息
安全性
食入 :低危險�,易造成老年癡呆�����,對小孩智力有損害
吸入 :可能造成刺激或肺部傷害
皮膚 :低危險
眼睛 :低危險
在沒有特別注明的情況下����,使用SI單位和標(biāo)準(zhǔn)氣溫和氣壓。
合成方法
(1)其制備方法有酸法����,堿法和醇鋁法三種。目前國內(nèi)主要采用堿法����,少數(shù)廠家采用醇鋁法。
酸法將硫酸鋁配成6%的水溶液����,加入中和槽中����,再將液氨配成15%~20%的氨水��,按計算量將氨水快速加入��,在強(qiáng)烈攪拌下于室溫反應(yīng)40~60 min��,至pH值達(dá)到8~9左右時�����,反應(yīng)基本完成�。將生成的沉淀物經(jīng)壓濾���、用無離子水洗滌除去雜質(zhì)離子����,洗滌水中一般加少量氨水調(diào)節(jié)pH值為8~9�,以防洗滌過程中氫氧化鋁發(fā)生膠凝過程而引起物料損失。將洗滌過的沉淀物加入少量33%的硝酸溶液��,在強(qiáng)烈攪拌下生成膠狀料漿(此過程稱為打漿)�����。再經(jīng)噴霧干燥,將得到的微球形氫氧化鋁擠條成型����,在550℃下焙燒活化4h,即脫水形成活性氧化鋁�。其
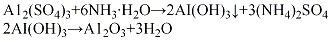
(2)堿法把工業(yè)固體燒堿加水配成濃度為600 g/L的燒堿溶液,在50~80℃下加入氫氧化鋁后升溫至110℃����,保溫3 h進(jìn)行反應(yīng),將所得溶液用水稀釋至含氧化鋁為100g/L�����,靜置0.5~1h���,經(jīng)過濾����,除去氫氧化鐵等不溶性雜質(zhì)�����,再將清液和20%硝酸溶液按照一定比例進(jìn)行中和反應(yīng)��,溫度控制在30~50℃下�,控制pH 7~7.5,反應(yīng)10 min 左右以后����,再將反應(yīng)液在常溫攪拌下老化2h,經(jīng)過濾�、用無離子水多次洗滌、于110℃烘干�、擠條成型、干燥�����、500℃活化4h�,制得活性氧化鋁。其

(3)醇鋁法將金屬鋁片加入異丙醇溶液中進(jìn)行反應(yīng)��,生成異丙醇鋁�����,通過水蒸氣鼓泡(入口溫度180℃����,水解溫度175℃)����,使異丙醇鋁水解����,生成水合氧化鋁,經(jīng)熟化���、過濾�����、于100℃干燥���、500℃脫水活化,制得活性氧化鋁�。其
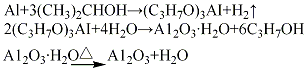
(4)高溫快脫法:將氫氧化鋁(水合氧化鋁)經(jīng)高溫快速脫水、成型���、水熱處理及干燥后制得成品���。
(5)炭化鋁膠法:將氫氧化鋁和氫氧化鈉混合,再經(jīng)中和���、二氧化碳碳化�����、水洗�、壓濾�、干燥、粉碎����、捏合、擠條����、干燥、煅燒等過程制得成品��。
(6)噴霧干燥法:將氫氧化鋁與工業(yè)硫酸反應(yīng)��,再經(jīng)堿液中和�、水洗、噴霧干燥�����、煅燒等過程制得成品。
(7)油柱成型法:將鋁錠用工業(yè)鹽酸溶解����,再經(jīng)油柱成球、水洗�����、干燥�、煅燒等過程制得成品。
制備過程中各種條件����,特別是沉淀條件對產(chǎn)品的晶型、表面積���、孔結(jié)構(gòu)等影響很大��,一般地�����,低溫����、低 pH 值下易得到無定形氫氧化鋁及擬薄水鋁石,高 pH 值易生成三水鋁石�����。擬薄水鋁石在 430~500℃下���,煅燒得到γ-Al2O3����,β三水鋁石在 300℃煅燒得到 η-Al2O3�����。
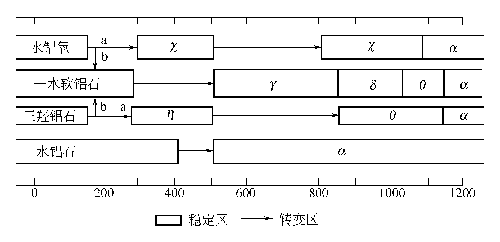
圖XIII-14 氫氧化鋁的脫水途徑
(8)高純銨明礬熱解法以硫酸鋁����、硫酸銨為原料合成銨明礬(硫酸鋁銨)��,經(jīng)脫水���、熱解生成氧化鋁�����,再經(jīng)轉(zhuǎn)相制得γ-���,α-氧化鋁����。
利用有機(jī)鋁化合物聚合生成黏稠的聚鋁氧烷溶液�����,將聚鋁氧烷溶液進(jìn)行干式紡絲���,得到有機(jī)鋁化合物纖維��,再經(jīng)煅燒制得氧化鋁纖維���。
使有機(jī)鋁化合物聚合,生成黏稠的聚鋁氧烷溶液��,將其利用普通的干式紡絲法����,制成有機(jī)鋁化合物纖維。再經(jīng)煅燒制得氧化鋁纖維。
9.制法 方法1.用蒸餾水溶解結(jié)晶硫酸鋁����,然后在不斷攪拌下慢慢加入硫酸銨溶液,制得硫酸鋁銨:
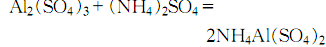
然后加熱至100~200℃����,除去結(jié)晶水后,研成粉末進(jìn)行高溫灼燒�����,開始在800℃ 灼燒����,然后升溫至1250~1300℃灼燒4h���,冷卻后即得氧化鋁:
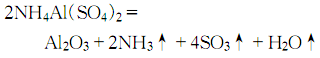
上下游產(chǎn)品信息
表征圖譜
相關(guān)文獻(xiàn)
用途
1.用作催化劑和催化劑載體�,是石油煉制和石油化工中主要的催化劑和載體����。還用作空氣及其他氣體的脫濕劑,變壓器油和透平油的脫酸劑��。
2.用于鍛造的加熱爐����、均熱爐等工業(yè)用的高溫爐�??勺髅芊獠牧虾吞畛洳牧稀_€可作強(qiáng)化用補(bǔ)強(qiáng)纖維����,窯爐的爐襯,電子元件(IC板�、鐵氧體)的煅燒爐等。
3.氧化鋁纖維主要用于高溫絕熱材料和增強(qiáng)復(fù)合材料�。氧化鋁短纖維具有突出的耐高溫性能,可與樹脂����、金屬或陶瓷進(jìn)行復(fù)合制備高性能復(fù)合材料,制造加熱爐����、窯爐襯里及電子元件煅燒爐等工業(yè)用高溫爐。由于其密度小�。絕熱性好、熱容量小����,不僅可以減輕爐體質(zhì)量��,而且可以提高控溫精度���,節(jié)能效果顯著。氧化鋁纖維在高溫爐中的節(jié)能效果比一般的耐火磚或高溫涂料好����。將其用于增強(qiáng)金屬時,與金屬完全不起化學(xué)作用�����,耐腐蝕性好���,因此氧化鋁纖維是金屬的增強(qiáng)纖維����。還可用于編織無紡布��、編織帶���、繩索等各種形狀的纖維制品。
4.用于制造加熱爐、均熱爐等工業(yè)用高溫爐�。用作密封材料、填充材料���、FRM用增強(qiáng)纖維��、窯爐襯里及電子元件(IC基板����、鐵氧體)煅燒爐等����。
5.主要用作化纖纖維填料,也用于化妝品磨面膏的磨面劑、牙膏摩擦劑及冶金和化學(xué)品中�。
6.分析試劑,有機(jī)溶劑的脫水吸附劑��,研磨劑��,低熔點(diǎn)鉛玻璃的配制�����。
7.氧化鋁是色譜中最常用的一種填充材料���,有酸性���、堿性和中性�����。是一種能進(jìn)行催化脫水�、消除�、加成、縮合��、環(huán)氧化物開環(huán)����、氧化和還原反應(yīng)的試劑,對于均相反應(yīng)來說反應(yīng)條件通常更溫和�����、更具有選擇性���。
加成與縮合反應(yīng) 無論是親電反應(yīng)還是親核反應(yīng),氧化鋁都可促進(jìn)各類雜原子的加成反應(yīng)����。氧化鋁也能使羥基和烷氧基發(fā)生分子內(nèi)加成生成相應(yīng)的烯烴 (式1)[2]��。
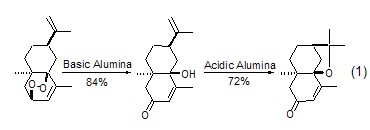
在氧化鋁的作用下���,醛和不同活性的亞甲基化合物之間的醇醛縮合反應(yīng)、Michael反應(yīng)和Wittig反應(yīng)常在無溶劑�����、溫和的條件下進(jìn)行��。硝基醇醛環(huán)化生成2-異唑啉的2-氧化物的反應(yīng)具有很好的立體選擇性 (式2)���。
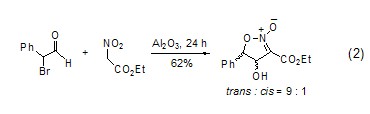
氧化鋁有利于Diels-Alder反應(yīng)��、烯烴反應(yīng)和Carroll重排等受軌道對稱性控制的反應(yīng)��。這些反應(yīng)條件溫和且有很高的立體選擇性�����。
在Al2O3的作用下�����,S可與環(huán)氧丙烷更易進(jìn)行親核加成反應(yīng)����,而后脫水形成烯 (式3)。
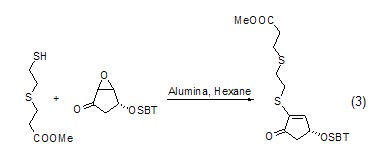
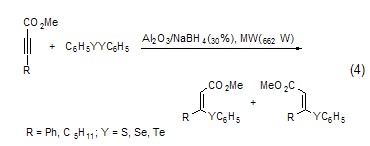
以氧化鋁為固相載體微波照射后反應(yīng)物中的S�、Se和Te可以與炔進(jìn)行親核加成,產(chǎn)物為α,β-不飽和酯 (式4)���。
環(huán)氧化反應(yīng) 在溫和的��、選擇性的條件下���,用醇、硫醇��、硒醇�、胺、羧酸和過氧化物等親核試劑可以使環(huán)氧化物發(fā)生開環(huán)反應(yīng)���。這種方法可用于順烯胺的合成 (式5)���。

氧化鋁可催化許多重排反應(yīng)?;钚缘难趸X使O-磺酰肟發(fā)生Beckmann重排生成預(yù)期的酰胺�,而堿性的氧化鋁生成相應(yīng)的唑啉�。在氧化鋁作用下���,β,γ-不飽和酮可異構(gòu)化為共軛酮����、炔烴異構(gòu)化成烯烴�����、烯烴異構(gòu)化成共軛雙烯醇化 (式6)�����。
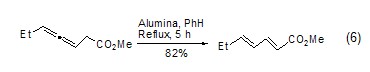
氧化鋁可促進(jìn)伯醇乙酸酯水解作用����、酰亞胺的脫酰作用、磺酰肟的水解作用和β-酮酸酯和氨基甲酸鹽的脫烷氧羰基化作用���。